|
| (fonte: Wikimedia Commons) |
Effetto Jolie
Le reazioni dei lettori sui siti dei giornali italiani che rilanciarono l'annuncio della Jolie erano quasi tutte critiche. “La vita è fatta di rischi che dobbiamo accettare”. “È folle rinunciare a un organo sano per prevenire una malattia”. “È solo una mossa pubblicitaria per attirare l'attenzione”. Liquidavano la scelta dell'attrice come il capriccio di una star danarosa che si illudeva di eludere il destino e comprare la salute con un costoso intervento.
Chi commentava in questo modo evidentemente non si rendeva conto che il rischio di sviluppare un tumore al seno per Angelina Jolie era ben più elevato di quello che corre una donna qualunque durante la sua esistenza, che è del 12% negli Stati Uniti, del 10% in Italia. La Jolie è portatrice di una mutazione, più esattamente di una variante patogena del gene BRCA1 che comporta l'87% di probabilità di avere un cancro al seno e il 50% di probabilità di averlo alle ovaie entro i 70 anni di età.
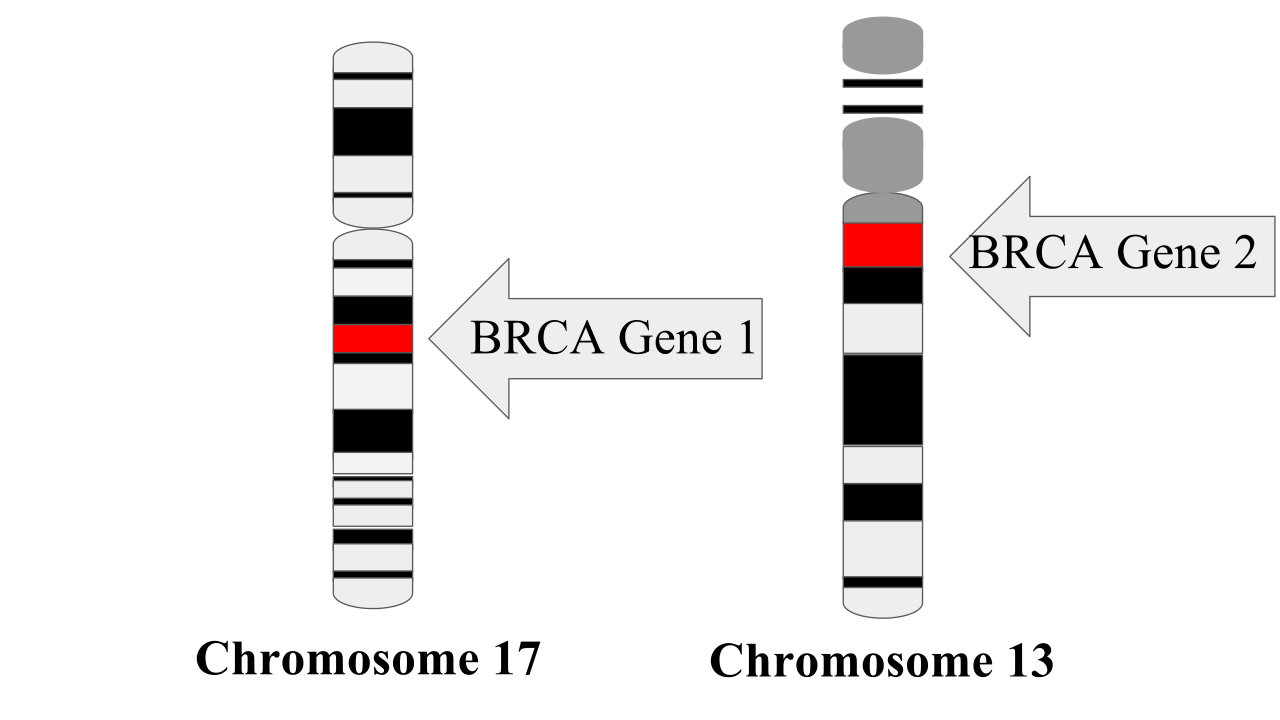 |
| Il gene BRCA1 sul cromosoma 17 e il BRCA2 sul cromosoma 13 |
“Esistono migliaia di varianti di BRCA1 e 2”, spiega Maurizio Genuardi, direttore dell'Istituto di Medicina Genomica dell'Università Cattolica di Roma e presidente della Società Italiana di Genetica Umana. “Molte sono non patogene: non arrecano alcun danno al funzionamento dei geni. Altre lo alterano in modo più o meno grave. Ciascuna di loro è associata a una diversa entità di rischio di cancro al seno e all'ovaio. A tutt'oggi, però, le nostre conoscenze al riguardo sono ancora limitate e non siamo in grado di calcolare con esattezza il rischio correlato a ogni variante. Possiamo dire che, a seconda del gene e della variante coinvolta, la probabilità per la portatrice di sviluppare un cancro al seno entro i 70 anni va dal 50 all'87%, per l'ovaio va dal 17 al 50%. Più della metà delle donne con variante patogena di BRCA1 si ammala prima dei 50 anni. Frequenti sono le forme tumorali particolarmente aggressive e resistenti al trattamento farmacologico”.
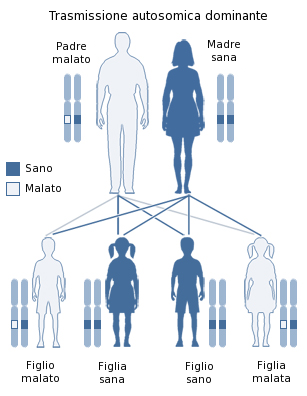
Sono cifre, dati astratti, per un lettore che non sia personalmente coinvolto. Per una donna mutata assumono la concretezza di una maledizione familiare, perché le varianti patogene sono ereditarie dominanti: ogni portatore o portatrice ha il 50% di probabilità di trasmettere la predisposizione al cancro ai propri figli. Spesso la storia familiare di queste persone è un susseguirsi di lutti, di perdite precoci, di devastanti esperienze di malattia.
“I rumori di casa, gli sguardi gonfi, le cure e la processione delle cartelle cliniche. La mappa mistica della malattia, le credenze superstiziose che si mescolavano alle diagnosi e alle prognosi allora ancora incerte sul cancro”, scrive Silvia Mari, portatrice di una variante patogena del gene BRCA2, la seconda donna in Italia a sottoporsi a mastectomia preventiva, lo stesso intervento di Angelina Jolie. Silvia ha raccontato la sua storia in un libro autobiografico, “Il Rischio”, pubblicato dall'Associazione Fontes nel 2010 e scaricabile gratuitamente qui. “Ricordo i discorsi sulla teoria della maledizione lanciata da mio nonno materno, le ipotesi sul sangue avariato dall'emigrazione e dalla povertà che avrebbe trasferito il male come un'infezione contagiosa da corpo a corpo, da madri a figlie. Le gravidanze e le nascite che diventavano sempre il sigillo di un anatema”.
Persone come Silvia Mari imparano fin da piccole che si ammaleranno e moriranno giovani come le proprie nonne, mamme, zie, che non possono fare progetti a lunga scadenza, che non vedranno crescere i propri figli.
Il test
A spezzare l'oscurità della maledizione c'è il test genetico, disponibile in Italia dalla fine degli anni '90. Si effettua su un campione di tessuto tumorale della donna già ammalata, oppure su un campione di sangue. “La mutazione patogena può non essere ereditata, ma insorgere casualmente nelle cellule della ghiandola mammaria, innescando un tumore”, spiega Genuardi. “Saperlo è importante, perché la conoscenza della specifica variante può dare indicazioni sulla scelta della terapia farmacologica più efficace. Per questo motivo oggi si sottopone la donna ammalata ad analisi genetica di un campione del tessuto tumorale, alla ricerca di una qualsiasi variante patogena di BRCA1 o 2. Si parla in questo caso di test diagnostico. Identificata la mutazione, oltre a impostare la terapia del caso si ripete l'esame sul sangue. Se la stessa variante è presente nel DNA del sangue, vuol dire che la mutazione è ereditaria. Si prospetta allora la possibilità di cercare la variante già identificata nelle altre persone della famiglia che potrebbero averla ereditata. In questo caso si parla di test predittivo”.
 |
| Il test se la donna è già ammalata (grafica: Monica Gewurz) |
 |
| Il test se la donna è sana (grafica: Monica Gewurz) |
Ma perché limitarsi alle donne già ammalate e alle famiglie con ricorrenza di tumori? Perché non sottoporre tutta la popolazione al test BRCA? “Perché può accadere che una variante patogena ricorra in una famiglia senza essere associata a una frequenza anomala di tumori del seno o delle ovaie”, risponde il genetista. “Ce ne accorgiamo sempre più spesso quando una donna si sottopone a sequenziamento completo del DNA per ragioni diverse dalla ricerca di mutazioni BRCA. Non è ammalata, non ha precedenti familiari e scopre casualmente di essere portatrice di una variante patogena di BRCA1 o 2. Vuol dire che il rischio teorico rappresentato dalla presenza della mutazione non sempre si concretizza, probabilmente a causa dell'interazione con altri geni o a causa di fattori ambientali. Dal momento che ne sappiamo ancora poco, però, una volta scoperta la variante patogena dobbiamo considerare quella donna come una persona ad alto rischio. Le raccomanderemo controlli serrati e le prospetteremo un intervento di chirurgia preventiva. Ecco perché non è consigliabile allargare il test a persone sane e senza precedenti familiari”.
Chi si sottopone all'esame deve mettere in conto anche la possibilità di un esito incerto. “Questo è un campo di studio in continua evoluzione”, spiega Genuardi. “Vengono scoperte progressivamente nuove varianti patogene e non patogene e su alcune non abbiamo abbastanza dati per dare un'interpretazione chiara. Ecco perché il test deve essere sempre preceduto e seguito da una consulenza fatta da un genetista oncologo, che possa fornire alla diretta interessata informazioni corrette e spiegarle il significato e i limiti del referto”.
La forza della consapevolezza
“Avere il responso positivo del test per me è stato liberatorio, la vittoria della ragione sulla superstizione. Può sembrare paradossale, ma è così”, dice Silvia Mari. “La mia situazione familiare era molto pesante e io la vivevo come un accanimento vessatorio del destino, di fronte a cui ero passiva e indifesa. Conoscere il perché di quella serie di lutti e sofferenze mi ha alleggerito, mi ha dato la forza di prendere la vita nelle mani. Le donne come me sono nate con una terribile ipoteca e se non fanno nulla, se rimangono passive, muoiono. È un incentivo formidabile che ci spinge ad essere consapevoli, determinate”.
Per aiutare le persone che portano questo fardello ad acquisire le informazioni più aggiornate sulla loro condizione, sugli sviluppi della ricerca, sulle opzioni disponibili e i percorsi di assistenza attivati nel nostro Paese, due anni fa è nata aBRCAdaBRA Onlus, un'associazione che riunisce donne e uomini portatori di mutazione BRCA, loro familiari, professionisti della salute e chiunque ne condivida gli scopi, fondata sotto l'egida del movimento Europa Donna Italia per i diritti delle donne nella prevenzione e cura del tumore al seno. “Ad oggi abbiamo un migliaio di soci”, spiega Ornella Campanella, fondatrice e presidente di aBRCAdaBRA. “Siamo informati e ci facciamo portatori di informazioni nelle nostre famiglie, ci adoperiamo per diffonderle nella società e per sensibilizzare i medici e le istituzioni sulle esigenze delle persone ad alto rischio. Partecipiamo a congressi e attività sul territorio, facciamo advocacy. In collaborazione con ACTO Onlus, Alleanza Contro il Tumore Ovarico, abbiamo lanciato su Youtube la campagna 'Io scelgo di sapere', con contributi video di pazienti e di esperti”.
È un campo, questo, in cui la conoscenza può fare la differenza tra la vita e la morte. “La vicenda di Angelina Jolie è servita a far parlare di rischio ereditario, di mutazioni BRCA, di chirurgia preventiva”, dice Alberta Ferrari, oncologa senologa dell'Unità Senologica del Policlinico San Matteo di Pavia e cofondatrice dell'associazione. “Ma ancora sono tante le donne non informate, sono tante quelle che muoiono per ignoranza. Sicuramente ci sono morti inevitabili, anche quando si fa il possibile, ma tante morti e malattie sarebbero evitabili se potessimo intercettare per tempo tutte le donne a rischio e metterle in sicurezza”.
C'è anche chi, trovandosi in una condizione di sospetto rischio ereditario, sceglie di non fare il test, di non sapere, e c'è chi lo fa e reagisce al responso positivo con fatalismo. “Sono scelte personali che dipendono dall'età, dalla storia, dai precedenti familiari”, osserva Campanella. “75 donne su 100 nella nostra associazione si sono sottoposte al test quando erano già ammalate. Nella loro situazione, conoscere il perché della malattia può essere di sollievo e aiuta nella scelta della terapia più adatta e nella gestione del rischio di future recidive. L'aver subito tanti lutti durante la vita può spingere al fatalismo, oppure all'autodeterminazione, alla volontà di sfuggire al destino. La maggior parte delle donne che ricevono un responso positivo sono giovani, sotto i 40 anni, in piena attività lavorativa, con figli piccoli o progetti di maternità. La prospettiva di non veder crescere i propri figli spinge molte sulla via della chirurgia preventiva, a volte subito e a volte dopo un periodo più o meno lungo di riflessione”.
Maria Grilli, socia di aBRCAdaBRA, è diventata un'esperta della sua condizione di portatrice di una variante patogena di BRCA1, ma solo di recente. “Si può dire che ho capito appieno che cosa significa solo nel 2015, nove anni dopo la diagnosi del mio primo tumore alla mammella destra”, racconta. “Mi asportarono parte del seno, mi sottoposero a chemio e radio e solo due anni dopo la senologa mi comunicò che era opportuno fare il test per la ricerca delle mutazioni. Il responso era positivo, ma nessuno mi spiegò chiaramente che cosa voleva dire, che stavo volando su un aereo che aveva l'87% di probabilità di precipitare, che il fatto di essermi ammalata una volta non riduceva il rischio di sviluppare altri tumori, come infatti accadde poco dopo, alla mammella sinistra. E poi di nuovo una terza volta. Nel 2015, informandomi e studiando, ho capito la situazione e ho ottenuto di farmi asportare la porzione residua di seno. Ora sto meglio, ma non posso ancora dire di esserne uscita. Quello che posso dire e che ripeto a tutte le donne con cui vengo in contatto attraverso la nostra associazione è che la conoscenza ti salva la vita ed è determinante affidarsi a un medico bene informato”.
Le vie disponibili
In che misura l'adozione di uno stile di vita sano e il controllo dei fattori di rischio ambientali può aiutare le portatrici di una variante patogena di BRCA?
“Non lo sappiamo”, risponde Alberta Ferrari. “Sicuramente i fattori ambientali giocano un ruolo nel rischio di cancro al seno e alle ovaie non solo per la popolazione generale, ma anche per le donne mutate. Un esempio per dimostrarlo: l'incidenza del cancro al seno in Polonia è inferiore a quella negli Stati Uniti. Anche le donne polacche con BRCA mutato corrono un rischio inferiore rispetto alle donne statunitensi con BRCA mutato. Se una donna polacca si trasferisce negli USA, il suo rischio aumenta e si allinea a quello statunitense. È la prova che alimentazione, stile di vita e fattori ambientali hanno un ruolo significativo nell'insorgenza del tumore al seno. Purtroppo, non sappiamo con certezza quali siano questi fattori e quanto pesi il loro contributo. La ricerca se ne sta occupando: è in corso uno studio dell'Istituto Italiano Tumori sull'alimentazione delle donne ad alto rischio. Si sta indagando anche sui cosiddetti interferenti endocrini, contaminanti ambientali che si legano ai recettori degli ormoni estrogeni della ghiandola mammaria, alterando l'assetto ormonale. Possono agire già in utero, sullo sviluppo del tessuto ghiandolare del feto, predisponendolo allo sviluppo di un tumore nel corso della vita”.
Lavorare sui fattori ambientali per prevenire la malattia nelle donne BRCA mutate, dunque, non è sufficiente. La medicina oggi offre due strade a chi si trova in questa situazione. La prima è quella dei controlli strumentali assidui, per diagnosticare tempestivamente l'eventuale insorgenza di un tumore e trattarlo quando le probabilità di guarigione sono più elevate. La seconda è la via della chirurgia preventiva: rimuovere gli organi bersaglio, ghiandole mammarie, ovaie e tube, prima che la malattia insorga. Ciascuna di queste due scelte ha i suoi pro e contro.
 |
| (fonte: Wikimedia Commons) |
È importante sapere che un programma di controlli serrati non è una misura preventiva contro il cancro al seno e all'ovaio. Non riduce il rischio di insorgenza, ma la mortalità. L'alternativa, l'unica misura ad oggi realmente preventiva che abbatte il rischio di ammalarsi, è la rimozione chirurgica degli organi.
“L'intervento di rimozione delle ovaie comporta l'avvio della menopausa”, spiega Alberta Ferrari, “e una menopausa precoce riduce l'aspettativa di vita e peggiora la qualità della vita: favorisce l'instaurarsi dell'osteoporosi, un aumento del rischio cardiovascolare e di numerosi altri disturbi. Per questa ragione si cerca di posticipare più possibile l'intervento, compatibilmente con l'entità del rischio associato alla mutazione e la volontà della diretta interessata. Se la percentuale di rischio è molto elevata, i benefici di una rimozione precoce sono superiori ai costi per la salute, come nel caso di Angelina Jolie, che infatti nel 2015 ha annunciato di aver tolto anche le ovaie. Alle più giovani ad alto rischio si può proporre un compromesso: rimuovere inizialmente solo le tube, lasciando per qualche anno ancora le ovaie. La maggior parte dei tumori ovarici, infatti, ha origine dal tessuto epiteliale delle tube e in questo modo si può prendere tempo e rimandare l'induzione della menopausa. In caso di rimozione delle ovaie a una donna che non ha ancora portato a termine il suo progetto riproduttivo, la fertilità può essere preservata congelando gli ovociti per un uso successivo con fecondazione assistita”.
 |
| (fonte: Wikimedia Commons) |
Quante sono le donne che hanno fatto questa scelta in Italia? “Non lo sappiamo, perché non esiste un registro nazionale dedicato”, risponde la senologa. “Di certo le donne ad alto rischio che vorrebbero sottoporsi a mastectomia preventiva sono più numerose di quelle che ci riescono, perché ancora oggi, nonostante l'evidenza scientifica dei vantaggi dell'intervento in termini di riduzione della mortalità, tanti medici lo sconsigliano o addirittura lo rifiutano. Nel 2008, la trasmissione Le Invasioni Barbariche di Daria Bignardi ospitò Anna Gazziero, la prima donna italiana che si era sottoposta alla rimozione, sette anni prima di Angelina Jolie, e Umberto Veronesi, il padre dell'oncologia italiana. Veronesi affermò che l'intervento era una soluzione di comodo, una scelta esagerata fatta per noia dei controlli periodici, per sedare un'ansia patologica. Quella sua dichiarazione ha influenzato e influenza tuttora tanti specialisti, nonostante in seguito lo stesso Veronesi si sia ricreduto, approvando le scelte di Angelina Jolie nel 2013 e nel 2015”.
“Ho visto anch'io quel video, diversi anni dopo la sua messa in onda e il mio intervento di mastectomia preventiva”, dice Silvia Mari. “Veronesi era assolutamente convinto di quel che diceva: lui era il paladino della chirurgia conservativa. E in effetti per una donna non mutata è un enorme beneficio poter conservare almeno in parte il seno. Per la donna portatrice di mutazioni BRCA non è così e le evidenze hanno smentito quel che Veronesi affermava. Sono ottimista: a distanza di quasi dieci anni, le conoscenze sono aumentate e si diffondono progressivamente tra i medici e tra la gente. Dobbiamo impegnarci perché si diffondano sempre più e per proteggere il servizio sanitario pubblico. Nonostante tutte le sue pecche, in Italia la sanità pubblica permette anche a una donna senza i mezzi economici della Jolie di affrontare un intervento complesso e costoso come quello che mi ha restituito la vita”.
Un percorso a ostacoli
Come dice Silvia Mari, le conoscenze si diffondono e l'assistenza alle portatrici di alto rischio ereditario sul territorio nazionale migliora, grazie anche all'impegno di associazioni come aBRCAdaBRA e di professionisti come Carlo Naldoni, oncologo e specialista di igiene e medicina preventiva, tra i fondatori dell'Osservatorio Nazionale Screening, ex presidente del Gruppo Italiano Screening Mammografico e per 24 anni responsabile dei programmi di screening della Regione Emilia Romagna per la prevenzione dei tumori femminili. Proprio la Regione Emilia Romagna è stata la prima, nel 2012, ad attivare un percorso totalmente gratuito per l'identificazione delle donne con sospetto rischio ereditario per il tumore al seno e alle ovaie e la loro presa in carico, che comprende l'offerta del test genetico, degli esami di approfondimento, dei controlli periodici, di counselling multidisciplinare e della chirurgia preventiva.
Le statistiche sulla frequenza delle mutazioni BRCA nella popolazione italiana e sui casi di carcinoma mammario legato a mutazioni BRCA. Carlo Naldoni spiega che si tratta, per il momento, solo di stime, in attesa che le i dati sul rischio ereditario vengano inclusi nel Registro Nazionale Tumori
“Abbiamo creato una rete tra le strutture attive sul territorio”, spiega Naldoni. “Alle estremità di questo sistema stanno i medici di medicina generale, gli specialisti senologi e i centri che amministrano lo screening mammografico offerto dal servizio sanitario pubblico. Queste tre entità hanno il compito di intercettare le donne con sospetto rischio ereditario, sottoponendo alle loro assistite un questionario per raccogliere dati relativi alla storia personale e familiare. A ogni evento descritto nel questionario, per esempio una parente di primo grado che ha sviluppato un tumore al seno in giovane età, viene attribuito un punteggio che contribuisce alla stima del rischio. Se il rischio calcolato in questo modo è superiore a una determinata soglia, la donna viene indirizzata a un centro di senologia, per una visita specialistica e una ricostruzione più accurata dell'albero genealogico e dei precedenti familiari. Il passo successivo è il colloquio con un genetista oncologo e l'offerta di sottoporsi al test. Qualora il responso fosse positivo, la donna viene presa in carico da una squadra multidisciplinare, con il contributo del genetista, dell'oncologo, del senologo e del ginecologo, del chirurgo plastico e dello psicologo. Le vengono prospettate le diverse possibilità: un programma di controlli serrati oppure la chirurgia preventiva, secondo tempi e modi differenti da persona a persona. L'ultima scelta spetta sempre e comunque alla diretta interessata. Esami, farmaci, visite specialistiche e interventi sono tutti a carico del servizio sanitario pubblico”.
Il Piano Nazionale Prevenzione 2014-2018 prevede la creazione di reti analoghe in tutte le Regioni entro l'anno prossimo, ma per il momento solo la Liguria sta seguendo le orme dell'Emilia Romagna. In Veneto è in corso un censimento delle strutture senologiche. “Nelle altre Regioni, soprattutto quelle del Sud, l'offerta del test e l'assistenza delle donne ad alto rischio è disorganizzata, a macchia di leopardo”, dice Alberta Ferrari.
Nel 2014 la Società Italiana di Genetica Umana e l'Associazione Italiana di Oncologia Medica hanno pubblicato un documento di indirizzo sui criteri per identificare le persone sane a cui offrire il test genetico. Tra i parametri di cui tenere conto per consigliare l'esame c'è l'insorgenza tra i parenti di primo grado di tumori al seno e alle ovaie in età precoce, tumori multipli, bilaterali, particolarmente aggressivi, tumori alla ghiandola mammaria maschili. Al momento in Italia questi criteri non vengono applicati in modo uniforme, anche perché non è uniforme la distribuzione delle strutture pubbliche che offrono il test. “La SIGU e l'AIOM stanno realizzando un censimento dei centri di qualità”, dice Maurizio Genuardi. “Sappiamo che nel pubblico sono pochi, totalmente assenti in alcune Regioni, e per questo hanno lunghe liste d'attesa. Al contrario, si sono moltiplicati i centri privati, che però non sempre garantiscono la qualità e spesso si limitano a consegnare il responso senza offrire la consulenza di un genetista preparato che ne spieghi il significato alla diretta interessata”.
L'importanza di fare rete con altre persone che vivono la medesima condizione di rischio: Maria Grilli ha incontrato specialisti che non hanno saputo informarla adeguatamente sull'alto rischio ereditario di cancro al seno e alle ovaie, per poi trovare finalmente le conoscenze che cercava attraverso i social media, mettendosi in contatto con l'associazione aBRCAdaBRA.
Anche l'accesso alla chirurgia preventiva oggi nel nostro Paese è eterogeneo e soggetto al giudizio del singolo specialista. Solo negli ultimi giorni l'Associazione Nazionale Italiana Senologi Chirurghi, con il contributo di aBRCAdaBRA e di Europa Donna Italia, ha pubblicato un documento per fare chiarezza sull'argomento e dare utili indicazioni ai medici e alle strutture sanitarie.
Vi si legge che il team multidisciplinare che ha preso in carico la donna ad alto rischio ereditario deve informarla in modo esaustivo e non dirigerla, lasciandola libera di “optare per le scelte che considera più opportune per sé in un preciso momento della sua vita”.
Vi si legge inoltre: “attualmente si ritiene che la chirurgia profilattica della mammella e della tuba/ovaio rappresentino l'intervento più efficace di riduzione del rischio di sviluppare un cancro della mammella e un cancro dell'ovaio”. Il documento elenca le indicazioni per la chirurgia profilattica, i dati disponibili sulla riduzione del rischio in funzione del gene mutato e dell'età della donna e prende in considerazione diversi casi: la portatrice di variante patogena già ammalata, la portatrice ancora sana, la donna negativa al test ma con una grave familiarità per il cancro al seno.
Il 17 settembre scorso, l'Osservatorio Nazionale sulla Salute della Donna, insieme a società scientifiche e associazioni di advocacy come aBRCAdaBRA, ha presentato un documento per chiedere alle autorità sanitarie nazionali e regionali l'implementazione di un percorso di prevenzione e cura del tumore ereditario della mammella e dell'ovaio.
“Chiediamo anche l'istituzione di un registro nazionale delle persone con mutazione BRCA e di chi si sottopone a chirurgia profilattica, linee guida nazionali, un sistema di accreditamento dei centri che offrono il test genetico, esenzione dal ticket per i controlli periodici e gli esami di approfondimento”, aggiunge Campanella.
Oltre alle autorità sanitarie, bisognerebbe sensibilizzare anche la gente comune sulla condizione e le esigenze delle donne con alto rischio ereditario, che siano già ammalate o sane. “Hanno la necessità di sottoporsi a controlli frequenti, affrontano interventi impegnativi benché siano donne sane e abbiano l'aspetto di donne sane: spesso riesce difficile per gli altri empatizzare con loro, con le loro difficoltà”, dice Maria Grilli. “Sul lavoro i colleghi talvolta le criticano per le assenze o perché non possono svolgere alcune mansioni, come se il loro fosse un capriccio. È un problema anche per tante donne ammalate ma che non lo danno a vedere. Io, per esempio, non posso sollevare pesi, non posso alzare completamente un braccio, ho una ferita che periodicamente si riapre, soffro di osteoporosi e altri disturbi a causa della menopausa precoce, però mi sono ricresciuti i capelli, non sono pallida ed emaciata, quindi sembro sana. È difficile far capire la questione a chi ci circonda”.
 |
| (fonte: Wikimedia Commons) |
Infine, c'è la questione della maternità. Le donne ad alto rischio ereditario che non escludono l'eventualità di avere dei figli devono affrontare scelte delicate. Anni fa, quando si cominciava a parlare di mutazioni BRCA, la rimozione delle ovaie era consigliata solo a chi aveva portato a termine il proprio progetto riproduttivo. Oggi la crioconservazione degli ovociti è una tecnica consolidata per preservare la fertilità e permette di rimuovere l'organo bersaglio senza sacrificare i progetti di maternità. Tuttavia, si tende ad aspettare comunque il più a lungo possibile, compatibilmente con il rischio, prima di rimuovere le ovaie e indurre la menopausa.
“Quando scoprii di essere portatrice di una mutazione e decisi di togliere il seno, non avevo progetti di maternità, non ero interessata all'idea di avere figli”, racconta Silvia Mari. “Aspettai a togliere le ovaie per evitare una menopausa molto precoce. Me lo potevo permettere perché con una variante patogena del gene BRCA2 eventuali tumori ovarici si manifestano di solito dopo i 40 anni. Avevo tempo. Da allora, alcune cose sono cambiate: ho conosciuto mio marito, ci siamo sposati e ho capito di volere dei figli con lui. Quindici mesi fa è nata la mia bambina. Ora sto cominciando a valutare l'idea di rimuovere le ovaie, magari dopo aver congelato gli ovociti”.
La possibilità di preservare la fertilità con la crioconservazione non viene offerta a tutte le donne che si sottopongono a trattamenti terapeutici o preventivi. “Per scarsa informazione e attenzione degli specialisti che prendono in carico la donna”, dice Alberta Ferrari. “Invece questa opzione dovrebbe far parte del percorso assistenziale standard, in modo omogeneo su tutto il territorio nazionale”.
C'è poi il rischio di trasmettere la mutazione ai figli e, soprattutto, alle figlie. “Oggi in Italia è legale, per le donne portatrici di varianti patogene dei geni BRCA, sottoporsi a procreazione assistita e chiedere la diagnosi preimpianto e l'impianto dei soli embrioni non portatori della mutazione”, aggiunge Ferrari. “In tante vi ricorrono, per avere la certezza di non trasmettere la predisposizione alla nuova generazione”.
 |
| (fonte: Wikimedia Commons) |
Silvia Mari aveva considerato questa possibilità. “Ma il concepimento è arrivato spontaneamente prima che avessi il tempo di decidere”, racconta. “Il timore di aver trasmesso la mutazione a mia figlia è con me dall'inizio della gravidanza. Sono fiduciosa nel fatto che da qui a 20-30 anni le armi per difendersi dal rischio ereditario saranno più efficaci e, nell'eventualità che mia figlia fosse mutata avremo modo di affrontare la situazione. Tuttavia, tremo al pensiero di quando lei, cresciuta, mi dirà: tu sapevi che cosa mi stavi passando”.
Maria Grilli ha due figli maschi, ancora minorenni. “Sarei più preoccupata se fossero state femmine”, dice, “ma un aumento del rischio c'è anche per gli uomini. Una mutazione del gene BRCA1 come la mia comporta una probabilità maggiore di insorgenza di tumore alla prostata, al colon e allo stomaco. Una mutazione di BRCA2, invece, nei maschi aumenta il rischio di melanoma, di tumore alla ghiandola mammaria e al pancreas. Quando avranno 18 anni penseremo a fare il test genetico”.
Attualmente l'esame non viene proposto ai minorenni. “In primo luogo per ragioni di privacy e per consentire al diretto interessato di esprimere la sua opinione su una questione così importante e delicata”, dice Maurizio Genuardi. “Inoltre, non è dimostrato alcun vantaggio nel mettere in atto controlli precoci o interventi preventivi prima dei 20 anni di età”.